Pharma knowledge and not only
Potenziare i linfociti T per la lotta ai tumori
Ne abbiamo parlato con il dott. Dario Sannino, da anni impegnato nel settore farmaceutico all'estero
domenica 25 agosto 2024
Ultimi studi sembrano confermare che la chiave di volta per le terapie del domani sembra risiedere nei raffinati meccanismi di riconoscimento cellulare, perno del buon funzionamento del sistema immunitario, e sulla possibilità di modificarli affinché riescano a vedere ciò che, fino ad ora, è sempre riuscito subdolamente a scomparire alla "vista" dei Linfociti T.
Ne abbiamo parlato col dott. Dario Sannino, da anni impegnato nel settore farmaceutico all'estero.
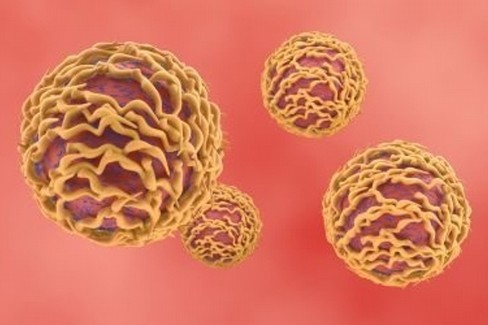
Tra i temi più accattivanti dell'immunologia non c'è solo il modo in cui i linfociti T riconoscono i virus o i batteri che minacciano l'organismo ma come essi riconoscano le cellule infettate dai patogeni. O che subiscono una trasformazione neoplastica. Tale affascinante meccanismo è all'origine della moderna immunoterapia secondo cui il sistema immunitario può essere messo in condizioni di prevalere anche su malattie gravi, quali il cancro. Diversi gruppi di ricerca nel mondo si stanno adoperando per capire come restituire ai linfociti T il vantaggio nella lotta alle cellule tumorali: dagli Stati Uniti arriva un'intrigante strategia, oggetto di una pubblicazione sulla prestigiosa rivista The Lancet.
Al centro dell'articolo c'è una tecnologia sviluppata da Adaptimmune LLC - un'azienda di biotecnologie di Philadelphia - e applicata ai linfociti T: è nota come SPEAR (Specific Peptide Enhanced Affinity Receptor) dal momento che prevede un riconoscimento di antigeni presenti sia all'interno che sulla superficie esterna della cellula, ampliando così il numero di proteine da prendere di mira e, con esse, la possibilità di sortire un effetto utile contro i tumori.
I linfociti T, infatti, sono considerati i generali dell'esercito di cellule - o, per non usare una similitudine bellica, i direttori di orchestra - da cui è composto il sistema immunitario , cioè coloro che dettano le indicazioni per aggredire e respingere gli elementi considerati estranei. Esistono più tipologie di linfociti T e un tratto peculiare di quelli in grado di riconoscere le cellule infettate consiste proprio nel comprendere la differenza tra ciò che appartiene al proprio corpo (self) e sapere se le cellule che sorvegliano siano, o meno, infettate. Ad aiutarli in quest'opera - per nulla semplice - è il complesso maggiore di istocompatibilità (MHC) di classe I che porta in superficie alcuni frammenti peptidici cosicché i linfociti li possano riconoscere. Tuttavia, affinché si crei il legame che permette ai linfociti T di individuare le cellule da colpire serve un altro elemento, noto come T Cell Receptor (TCR, cioè il recettore dei linfociti T), grazie a cui i linfociti T si attivano e rilasciano il loro contenuto annientando la cellula "nemica". Nei laboratori di Adaptimmune LLC si è scelto di lavorare esattamente sulle potenzialità di questa molecola.
L'articolo apparso su The Lancet descrive i risultati di SPEARHEAD-1, un trial clinico multicentrico di Fase II a cui hanno aderito diversi centri negli Stati Uniti, in Canada, Francia, Spagna e Regno Unito. In particolare, il prodotto testato nello studio è afamitresgene autoleucel (afami-cel, precedentemente conosciuto con la sigla ADP- A2M4), diretto contro un antigene della famiglia MAGE espresso in un certo numero di tumori solidi (tra cui quelli a vescica, ovaio, esofago e stomaco, e anche nel melanoma, nel tumore del polmone non a piccole cellule, nel sarcoma sinoviale e nel liposarcoma mixoide a cellule rotonde, MRCLS).
In un precedente studio di Fase I era stata valutata la sicurezza di questa terapia innovativa nella quale l'affinità del recettore delle cellule T viene modificata per permettere il riconoscimento delle cellule tumorali: ingegnerizzando una specifica regione del recettore TCR gli scienziati sono riusciti ad aumentare la complementarità con il complesso MHC della cellula tumorale. Il più interessante vantaggio della piattaforma tecnologica di Adaptimmune LLC è legato al fatto di disporre di intere librerie di antigeni espressi in maniera specifica nei tumori (e non nei tessuti sani), in modo tale da prediligere quelli che minimizzano il rischio di suscitare processi di cross- reattività, risultando così maggiormente efficaci nel contrasto alle cellule del tumore. Una volta identificato e validato il peptide bersaglio si costruisce un TCR ingegnerizzato a partire da una versione naturale da dirigere contro il bersaglio scelto.
Lo studio SPEARHEAD-1 è suddiviso in tre coorti, la prima delle quali è stata descritta su Lancet e comprendeva pazienti adulti (tra 16 e 75 anni) affetti da sarcoma sinoviale e MRCLS, metastatici o non asportabili chirurgicamente, esprimenti l'antigene MAGE- A4. Nei primi due anni di ricerca - tra il 2019 e il 2021 - 52 individui (44 affetti da sarcoma delle sinovie e 8 da liposarcoma mixoide a cellule rotonde) sono stati arruolati e hanno ricevuto una dose di afami-cel, con un tasso di risposta globale del 37% e una insorgenza della sindrome da rilascio delle citochine (CRS) nel 71% dei casi (con un solo evento avverso di grado 3). Le risposte sono state considerate durature e l'attendibilità di afami-cel nel contrasto ai tumori solidi in pazienti già sottoposti a precedenti regimi di trattamento sembra concreta, aprendo così la scena a un nuovo approccio per potenziare il sistema immunitario e trattare malattie ancora incurabili.
Naturalmente, il percorso di sviluppo di farmaci di questo tipo è ancora all'inizio e gli scienziati stanno alacremente lavorando per elevare l'efficacia e la sicurezza delle nuove molecole, riducendo al minimo i rischi per i malati. Tuttavia, si tratta di un percorso che gode di ottima considerazione ed è affine a quello che stanno intraprendendo anche gli scienziati del San Raffaele di Milano, i quali stanno facendo in modo che i TCR dei linfociti possano riconoscere alcuni antigeni non chiaramente esposti sulla superficie cellulare del tumore.
Ne abbiamo parlato col dott. Dario Sannino, da anni impegnato nel settore farmaceutico all'estero.
Tra i temi più accattivanti dell'immunologia non c'è solo il modo in cui i linfociti T riconoscono i virus o i batteri che minacciano l'organismo ma come essi riconoscano le cellule infettate dai patogeni. O che subiscono una trasformazione neoplastica. Tale affascinante meccanismo è all'origine della moderna immunoterapia secondo cui il sistema immunitario può essere messo in condizioni di prevalere anche su malattie gravi, quali il cancro. Diversi gruppi di ricerca nel mondo si stanno adoperando per capire come restituire ai linfociti T il vantaggio nella lotta alle cellule tumorali: dagli Stati Uniti arriva un'intrigante strategia, oggetto di una pubblicazione sulla prestigiosa rivista The Lancet.
Al centro dell'articolo c'è una tecnologia sviluppata da Adaptimmune LLC - un'azienda di biotecnologie di Philadelphia - e applicata ai linfociti T: è nota come SPEAR (Specific Peptide Enhanced Affinity Receptor) dal momento che prevede un riconoscimento di antigeni presenti sia all'interno che sulla superficie esterna della cellula, ampliando così il numero di proteine da prendere di mira e, con esse, la possibilità di sortire un effetto utile contro i tumori.
I linfociti T, infatti, sono considerati i generali dell'esercito di cellule - o, per non usare una similitudine bellica, i direttori di orchestra - da cui è composto il sistema immunitario , cioè coloro che dettano le indicazioni per aggredire e respingere gli elementi considerati estranei. Esistono più tipologie di linfociti T e un tratto peculiare di quelli in grado di riconoscere le cellule infettate consiste proprio nel comprendere la differenza tra ciò che appartiene al proprio corpo (self) e sapere se le cellule che sorvegliano siano, o meno, infettate. Ad aiutarli in quest'opera - per nulla semplice - è il complesso maggiore di istocompatibilità (MHC) di classe I che porta in superficie alcuni frammenti peptidici cosicché i linfociti li possano riconoscere. Tuttavia, affinché si crei il legame che permette ai linfociti T di individuare le cellule da colpire serve un altro elemento, noto come T Cell Receptor (TCR, cioè il recettore dei linfociti T), grazie a cui i linfociti T si attivano e rilasciano il loro contenuto annientando la cellula "nemica". Nei laboratori di Adaptimmune LLC si è scelto di lavorare esattamente sulle potenzialità di questa molecola.
L'articolo apparso su The Lancet descrive i risultati di SPEARHEAD-1, un trial clinico multicentrico di Fase II a cui hanno aderito diversi centri negli Stati Uniti, in Canada, Francia, Spagna e Regno Unito. In particolare, il prodotto testato nello studio è afamitresgene autoleucel (afami-cel, precedentemente conosciuto con la sigla ADP- A2M4), diretto contro un antigene della famiglia MAGE espresso in un certo numero di tumori solidi (tra cui quelli a vescica, ovaio, esofago e stomaco, e anche nel melanoma, nel tumore del polmone non a piccole cellule, nel sarcoma sinoviale e nel liposarcoma mixoide a cellule rotonde, MRCLS).
In un precedente studio di Fase I era stata valutata la sicurezza di questa terapia innovativa nella quale l'affinità del recettore delle cellule T viene modificata per permettere il riconoscimento delle cellule tumorali: ingegnerizzando una specifica regione del recettore TCR gli scienziati sono riusciti ad aumentare la complementarità con il complesso MHC della cellula tumorale. Il più interessante vantaggio della piattaforma tecnologica di Adaptimmune LLC è legato al fatto di disporre di intere librerie di antigeni espressi in maniera specifica nei tumori (e non nei tessuti sani), in modo tale da prediligere quelli che minimizzano il rischio di suscitare processi di cross- reattività, risultando così maggiormente efficaci nel contrasto alle cellule del tumore. Una volta identificato e validato il peptide bersaglio si costruisce un TCR ingegnerizzato a partire da una versione naturale da dirigere contro il bersaglio scelto.
Lo studio SPEARHEAD-1 è suddiviso in tre coorti, la prima delle quali è stata descritta su Lancet e comprendeva pazienti adulti (tra 16 e 75 anni) affetti da sarcoma sinoviale e MRCLS, metastatici o non asportabili chirurgicamente, esprimenti l'antigene MAGE- A4. Nei primi due anni di ricerca - tra il 2019 e il 2021 - 52 individui (44 affetti da sarcoma delle sinovie e 8 da liposarcoma mixoide a cellule rotonde) sono stati arruolati e hanno ricevuto una dose di afami-cel, con un tasso di risposta globale del 37% e una insorgenza della sindrome da rilascio delle citochine (CRS) nel 71% dei casi (con un solo evento avverso di grado 3). Le risposte sono state considerate durature e l'attendibilità di afami-cel nel contrasto ai tumori solidi in pazienti già sottoposti a precedenti regimi di trattamento sembra concreta, aprendo così la scena a un nuovo approccio per potenziare il sistema immunitario e trattare malattie ancora incurabili.
Naturalmente, il percorso di sviluppo di farmaci di questo tipo è ancora all'inizio e gli scienziati stanno alacremente lavorando per elevare l'efficacia e la sicurezza delle nuove molecole, riducendo al minimo i rischi per i malati. Tuttavia, si tratta di un percorso che gode di ottima considerazione ed è affine a quello che stanno intraprendendo anche gli scienziati del San Raffaele di Milano, i quali stanno facendo in modo che i TCR dei linfociti possano riconoscere alcuni antigeni non chiaramente esposti sulla superficie cellulare del tumore.



.jpg)
.jpg)
.jpg)
 Ricevi aggiornamenti e contenuti da Giovinazzo
Ricevi aggiornamenti e contenuti da Giovinazzo 
.jpg)

.jpg)






